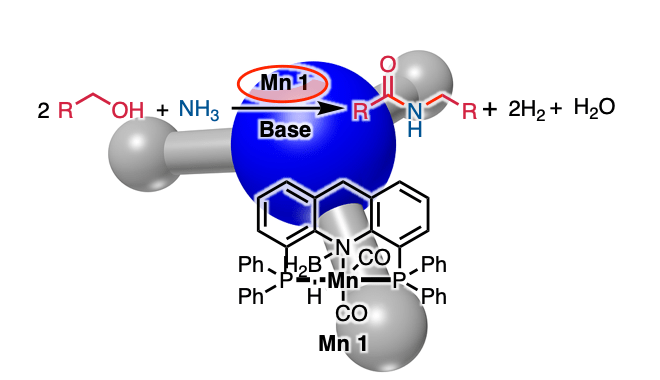
通过使用苯甲醇与氨作为氮源进行脱氢偶联成功地合成了酰胺。使用化学计量的碱选择性合成仲酰胺而不是亚胺
酰胺合成法
由于酰胺广泛用于聚合物,生物活性物质和药物的合成,因此开发有效的酰胺合成方法所产生的涟漪效应是很广泛的。
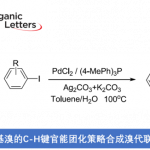
常用的酰胺合成方法是使用缩合剂对羧酸和胺进行脱水缩合,但这种方法不可避免地会释放大量副产物(图1A)[1]。
2007年,Milstein等人报道了使用Pincer Ru催化剂通过醇和胺的脱氢偶联合成酰胺的方法,该方法具有出色的原子效率(图1B)[2]。该反应的关键是首先使用了钳式金属催化剂进行脱氢偶联。
在上述反应报道之后,学术界使用各种夹钳金属催化剂合成酰胺的报道也相继出现。2009年,Grützmacher等人开发了使用新型钳形Rh催化剂由醇和氨合成伯酰胺的方法(图1C)[3]。但是,还存在使用贵金属作为催化剂的问题。使用廉价金属进行的酰胺化反应也有过报道,比如使用Mn金属催化剂(图1B)。但是,这是使用醇和胺为底物进行酰胺的合成方法,氨不能用作氮源。
这次、Milstein等人使用钳形Mn催化剂1、成功通过醇和氨的脱氢偶联合成仲酰胺(图1D)。反应的关键是使用化学计量的碱。
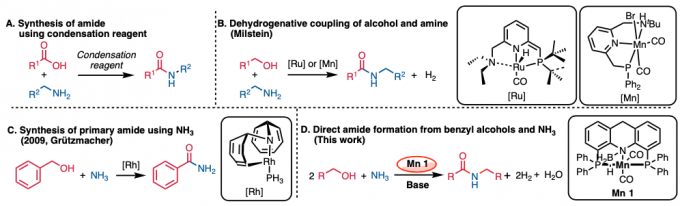
图1. (A) 使用缩合剂合成酰胺 (B) 脱氢偶联合成酰胺 (C) 使用NH3合成伯酰胺 (D) 这次介绍的反应
“Direct Synthesis of Amides by Acceptorless Dehydrogenative Coupling of Benzyl Alcohols and Ammonia Catalyzed by a Manganese Pincer Complex: Unexpected Crucial Role of Base”
Daw, P.; Kumar, A.; Espinosa-Jalapa, N. A.; Ben-David, Y.; Milstein, D. J. Am. Chem. Soc.2019, 141, 12202.
DOI:10.1021/jacs.9b05261
论文作者介绍
研究者经历:
1976 Ph.D, Hebrew University of Jerusalem, Israel(Prof.J. Blum)
1977-1978 Posdoc, Colorado State University (Prof. J. K. Stille)
1979-1982 Senior Research Chemist, Central Research and Development Department, DuPont Co.
1983-1986 Group Leader, DuPont Co.
1987-1992 Associate Professor, Department of Organic Chemistry, Weizmann Institute of Science
1993- Full Professor, Department of Organic Chemistry, Weizmann Institute of Science
1996-2005 Head, Department of Organic Chemistry, Weizmann Institute of Science
1996- The Israel Matz Professorial Chair of Organic Chemistry, Weizmann Institute of Science
2000-2017 Founder and Head, Kimmel Center for Molecular Design, Weizmann Institute of Science
研究内容:选择性官能团化的开发,绿色均相催化剂的开发与应用
论文概要
在该反应中,使用Mn催化剂1,在甲苯溶剂中,使苄醇2与化学计算量的氢化钾和氨在150度下在甲苯溶剂中反应,可以高收率得到酰胺3(图2A)。
尽管对于在邻位(3b)具有取代基的苯甲醇只能得到中等产率,但是具有甲氧基(3c)和二甲基氨基(3d)的苯甲醇适用于该反应(图2A)。
碱的用量很重要,当使用催化量的碱时,以亚胺4为主要产物。
另外,在Mn催化剂的存在下,亚胺4在1,4-二恶烷/水溶剂中反应不能得到仲酰胺5(图2B)。从这些结果和各种实验结果,作者提出了以下反应机理(图2C)。首先,由等量的碱和醇A得到醇盐B。在高温, 大量氨存在的情况下,随着B到A的再生,形成酰胺钾。然后A与Mn催化剂反应,经由β–脱氢后得到对应的醛。将酰胺钾添加到该醛中以生成氨基醇C。在这里,Mn催化剂与C发生β–氢消除、形成1级酰胺盐D。最后醛与酰胺盐最後D在Mn催化作用下发生脱水反应,得到目标产物二级酰胺盐E。对于本反应机理,作者注意到,C及其等效F是所需的第二次β-氢消除过程中的重要中间体。即,C和F的脱水过程(羟基消除)缓慢,并且抑制了作为副反应路径的亚胺形成。
使用氨作为氮源和贱金属锰作为催化剂的该反应可以期望以低成本和良好的原子效率被用作酰胺合成。
后记
关于各种对照实验和由此得出的结论的看法。
①在Scheme 2b中,使用Mn催化剂1和化学计量的KH从苄醇和苄胺获得目标酰胺。但是,当将氨气添加到该条件时,仅获得非常少量的酰胺(Scheme 3A)。结论是苄胺不是中间体。 个人觉得这个结论有矛盾之处。
②Scheme 2c中在Mn催化剂存在下、即使亚胺4在1,4-二氧六环/水溶液中反应也无法得到2级酰胺5,因此作者结论为亚胺不是中间体。然而,在该反应中,最多仅生成1当量的水,并且尚未确认该脱氢酰胺合成反应是否在过量水添加的条件下进行。得出亚胺不是中间体的结论还为时过早,因为不可能排除由于亚胺在大量过量的H2O中快速水解而无法获得酰胺的可能性。
考虑到以上两点,除了本文提出的反应机理外,还有可能存在更合理的反应机理。
参考文献
- Montalbetti, C. A. G. N.; Falque, V. Amide Bond Formation and Peptide Coupling. Tetrahedron2005, 61, 10827. DOI: 10.1016/j.tet.2005.08.031
- (a) Gunanathan, C.; Ben-David, Y.; Milstein, D. Direct Synthesis of Amides from Alcohols and Amines with Liberation of H2. Science 2007, 317, 790.DOI:1126/science.1145295(b) Kumar, A.; Espinosa-Jalapa, N. A.; Leitus, G.; Diskin-Posner, Y.; Avram, L.; Milstein, D. Direct Synthesis of Amide by Dehydrogenative Coupling of Amines with either Alcohols or Esters: Manganese Pincer Complex as Catalyst. Angew. Chem., Int. Ed. 2017, 56, 14992. DOI: 10.1002/anie.201709180
- Zweifel, T.; Naubron, J. V.; Grüetzmacher, H. Catalyzed Dehydrogenative Coupling of Primary Alcohols with Water, Methanol, or Amines. Chem., Int. Ed. 2009, 48, 559. DOI: 10.1002/anie.200804757
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!


























No comments yet.