通过模块化组合的模式达成了pleuromutilin类的简短工程合成。该方法也可以用于其衍生物的合成,极有可能加速新型抗生素的发现。
Pleuromutilins
近年来在抗生素领域由于耐药性的问题,新型抗生素的研究着重于新的作用机制(新靶点)的抗生素的发现。
从Pleurotus类细菌中分离出来的二萜类化合物,(+)-pleuromutilin(1)是一种通过非常稀有的机理,对核糖体的peptidyl transferase center作用的化合物,因此可能成为抗菌化合物中「最后的堡垒」(图1A)。
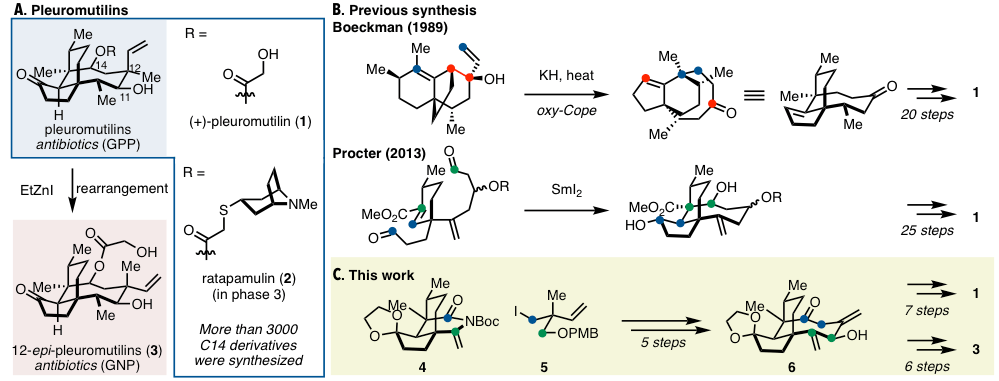
图1. Pleuromutilin类与过去的合成例
而实际上(+)-pleuromutilin(1)的C14位修饰体(2: retapamulin)已经进行到了临床三期[1]。它的C14位修饰体除了能够成为革兰氏阳性菌(GPP)的抗生素外,最近发现12-epi-pleuromutilins(3)的C12位侧链的诱导体对革兰氏阴性菌(GNP)也具有抑制性。C14位的修饰体与3这些类似物都是(+)-pleuromutilin(1)的半合成产物,而半合成由于自身具有局限性,所以合成的相似的衍生物的种类也是受限的。因此,如何开发一种高效,广泛的全合成路线是拓宽其类似物的多样性,并且发现新的更有效的抗生素的一种必不可少的手段。
而具有八个手性碳的复杂骨架的pleuromutilin(1),其全合成并不容易。从它被分离出来到目前为止已经过去60年了,全合成实例也只有Gibbons(1982年)、Boeckman(1989年)、Procter(2014年)这3例[2]。图1B是Boeckman与Proctor等人的合成法,在构筑好三环结构后,也都需要20多步的直线路径才能达成1的全合成(总的27–34步)。
这篇文章主要介绍耶鲁大学的Herzon教授,开发的新的短步骤的合成方法合成了手性化合物1,并且通过这种方法也能合成多种多样的类似物。
“A modular and enantioselective synthesis of the pleuromutilin antibiotics”
Murphy, S. K.; Zeng, M.; Herzon, S. B. Science 2017, 356, 956.
论文作者

研究者经历:
1998–2002 BSc, Temple University (Prof. Grant R. Krow)
2002–2006 PhD, Harvard University (Prof. Andrew G. Myers)
2006–2008 Posdoc, University of Illinois, Urbana-Champaign (Prof. John F. Hartwig)
2008–2012 Assistant Prof, Yale Chemistry
2012–2013 Associate Prof, Yale Chemistry
2013–present Prof, Yale Chemistry
研究内容:天然产物全合成、化学生物学、反应方法学开发
论文概要
在这篇全合成中,作者是如何高效连接各个unit的?
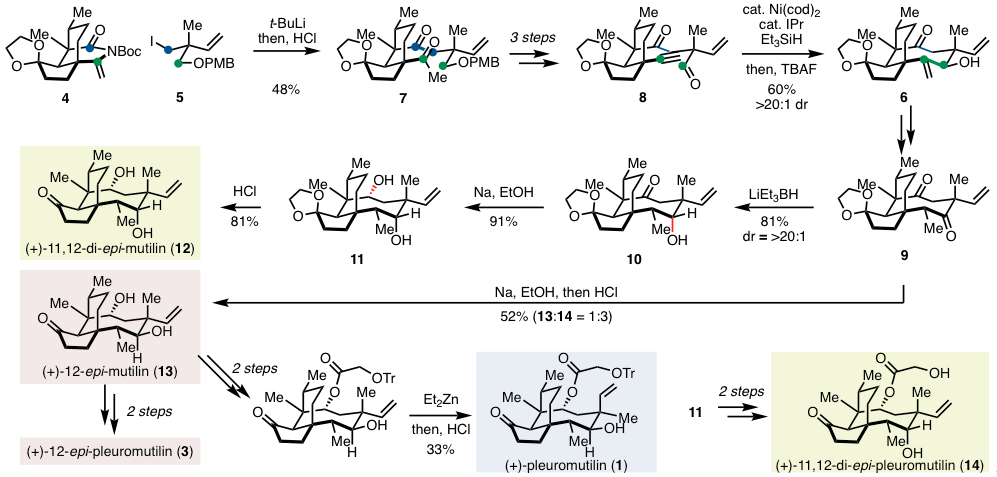
这里,笔者省略了各个unit的详细的合成路线,在作者的大量的实验后,他们采用了下图所示的4与5两个片段。首先,5在锂离子化后对4进行亲核加成反应,再通过酸处理得到二酮7. 起初,作者并没有用片段4,而是用一些酯等非环状的含有亲电子基团的底物进行讨论,然而基本没有反应。环状的带α位为双键的N-Boc的高亲电性是本反应进行的必须要素。
在这之后通过三步得到炔烃醛8后,再进行第二次片段的连接。这一步是末端炔烃与醛的还原环化反应,而这种反应用于形成中元环还未有先例。作者进过筛选反应后,利用Montogomery等人报道的Ni/IPr催化体系,实现了exo选择性环化,并且得到了良好的产率与非对映选择性,合成了8元环的9 [3]。
9作为共通中间体,对二酮进行非对映选择性还原加上有机锌试剂的重排反应合成了多种类似衍生物。具体的反应是用LiEt3BH作用于中间体9进行选择性酮还原,合成了动力学favor的10,然后合成了(+)-11,12-di-epi-mutilin(12)。另一方面,9的两个酮羰基在金属Na的存在下同时被元环,得到了(+)-12-epi-mutilin(13),虽然产率与非对映选择性都比较一般。然后以13为中间体,可以合成(+)-pleuromutilin(1),12-epi-pleuromutilins(3),并且还能合成C11、C12位epimer的化合物14.
参考文献
- Thirring, K.; Heilmayer, W.; Riedl, R.; Kollmann, H.; IVEZIC-SCHOENFELD, Z.; WICHA, W.; Paukner, S.; Strickmann, D. U.S. Patent WO2015110481A1
- (a) Gibbons, E. G. Am. Chem. Soc. 1982, 104, 1767. DOI: 10.1021/ja00370a067(b) Boeckman, R. K.; Springer, D. M.; Alessi, T. R. J. Am. Chem. Soc. 1989, 111, 8284. DOI: 10.1021/ja00203a043 (c) Fazakerley, N. J.; Helm, M. D.; Procter, D. J. Chem. Eur. J. 2013, 19, 6718. DOI: 10.1002/chem.201300968
- Wang, H.; Negretti, S.; Knauff, A. R.; Montgomery J. Lett. 2015, 17, 1493. DOI: 10.1021/acs.orglett.5b00381
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!



















No comments yet.