开头
上一回小编介绍了一下羧酸铑催化的卡宾的C-H插入反应的一些必备知识与发展情况,这一回,小编准备深度分析一下最近羧酸铑催化领域的大牛Huw M. L. Davies发的最新的一篇文章。
Site-selective and stereoselective functionalization of unactivated C–H bonds
Kuangbiao Liao, Solymar Negretti, Djamaladdin G. Musaev, John Bacsa & Huw M. L. Davies*
Department of Chemistry, Emory University, United States
Nature 533, 230–234
在上一回中小编也说过,现在在羧酸铑催化领域甚至是整个催化领域,“逆反应性”的site selective的活化是一个最有挑战性的工作,而近年来研究人员也正在朝着这个方向在努力。
背景实例
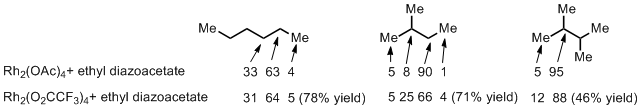
对于一些烷烃的C-H活化很早之前就已经有人尝试过了,1981年Teyssie, P.1等人利用下图所示的这几种烷烃(Scheme 4),通过羧酸铑催化剂实现了C-H插入反应。下图的数值是各个反应位点的产物的比例,对于直链烷烃来说,明显二级C-H的活性要远远高于末端一级C-H(电子效应),而对于中间的2-butane来说,同时受到位阻的影响,相对于最富电子的三级C-H来说,依然是二级C-H的活性最高。而把羧酸铑改成三氟乙酸铑的话,由于配体的缺电性增强,导致了对于2-butane底物来说,三级C-H的富电子优势就显现出来了,选择性从8:90增加到了25:66,所以看过第一回的读者就应该想起来小编叙述过的电子效应与位阻效应双重影响的问题了。
Scheme 4: For reactions with ethyl diazoacetate, arrows define site of C-H Insertion to alkane
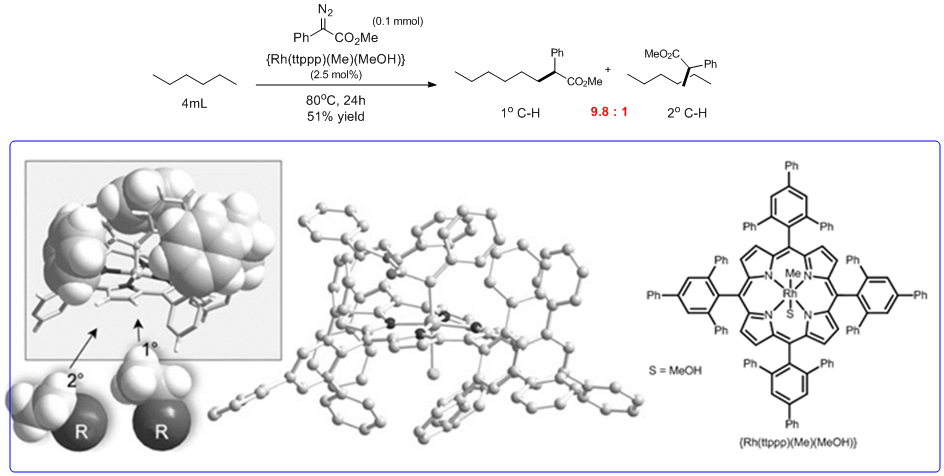
对于直链无取代烷烃的话,硬是要扭转反应的选择性,实现一级C-H的选择性C-H活化的话,着实是一个很挑战的工作。除了电性差异的话,我们可以发现二级C-H位阻要比末端的一级C-H的位阻要大那么一丁点,所以目前来说,如何通过催化剂把这个位阻的差异放大,从而实现一级C-H的选择性插入就成为了一个可行的方法。以下就是一个成功的实例。che2等人利用一个多苯环取代的卟啉作为配体合成了下图所示的位阻很大的催化剂(Scheme 5),而从催化剂的单晶可以看出,配体中的多取代苯环包裹住了Rh活性中心,只是留出一个很狭窄的“通道”,从而导致直链烷烃的二级碳很难进入这个“通道”,最终利用位阻效应,实现了“逆反应性的”一级C-H的选择性插入反应。这是一个非常有意义的工作,催化剂就像一个放大镜,把一级与二级碳的微小的位阻差异放大,达成逆反应性的site-selective插入的目的。
Scheme 5: Selective intermolecular carbene insertion to primary C-H bonds
今天的主题介绍
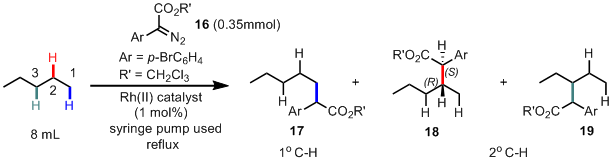
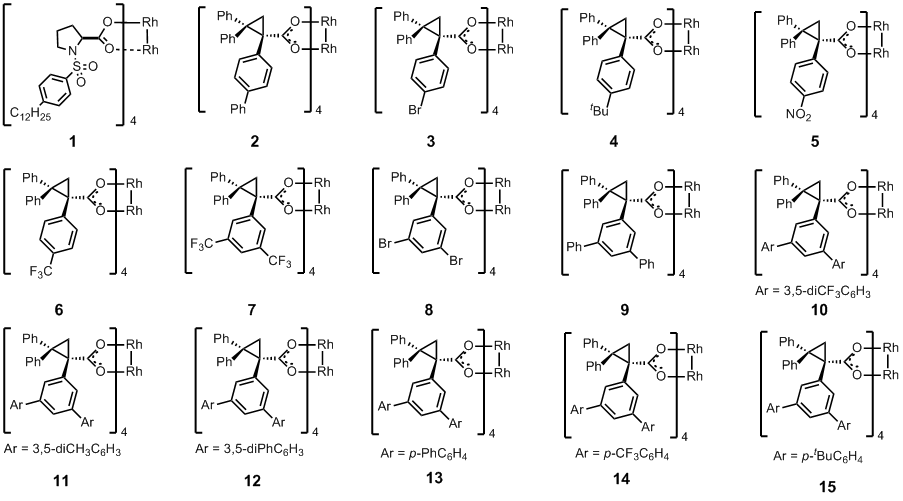
而今天要介绍的也是这样一个类似的以烷烃为原料的C-H插入反应,下图是该反应的催化剂筛选(Table 1)。到这里,作者估计就准备开始扩底物了,其实在小编看来,这个文章题目所谓的site-selective有点吹牛逼,本身底物的反应性就是C2最高,只是稍微扩大了一点这个位置的选择性而已。
首先作者利用他们很早就开发的Rh2(DOSP)4(催化剂1)尝试这个反应,发现基本只得到C2位置的插入产物18(其实这个很正常,因为中间的C3位阻很大,而末端的C1相对二级碳来说缺电子,活性差),不过ee还不错,有82%,然后估计作者也是受到前面che等人的启发,所以换了另外一种位阻比较大的催化剂(下图中除了1以外的含有环丙烷的配体的催化剂),从催化剂2–7的结果来看,哎哟,不错耶,一级C-H的插入底物最大有1/3耶(entry 2),并且这个dr跟ee都很不错哦,有戏(小编认为作者最初的想法只是想做一级C-H的site-selective插入,不过到这里发现stereoselective一样很好,估计小激动了一把),另外催化剂6,7的配体上含有三氟甲基,明显比别的配体缺电子,所以也很自然的导致了相对富电子的二级C-H的选择性提高到了11:1(entry 7)。接着从10–15,作者的意图就很明显了,通过在3,5-位置再次引入取代的芳香环,继续加大催化剂的位阻。最后发现这个一级C-H的选择性没上去(纯属小编自己的推测),但是stereoselective变得超好,dr=20:1,ee=99%(entry 15)。
| Rh2
catalyst |
Site selectivity
(17 : 18 : 19 ratio) |
Diastereoselectivity
(d.r. for 18) |
Enantioselectivity
(e.e.% for 18) |
Combined
yield (%) |
| 1 | n.d. : 29 : 1 | 3 : 1 | 82 | 98 |
| 2 | 1 : 2 : n.d. | 14 : 1 | 92 | 97 |
| 3 | 1 : 4 : n.d. | 6 : 1 | 91 | 98 |
| 4 | 1 : 5 : n.d. | 15 : 1 | 92 | 95 |
| 5 | 13 : 36 : 1 | 3 : 1 | 79 | 82 |
| 6 | 1 : 7 : n.d. | 5 : 1 | 94 | 87 |
| 7 | 1 : 11 : n.d. | 8 : 1 | 81 | 92 |
| 8 | 1 : 26 : n.d. | 5 : 1 | 78 | 95 |
| 9 | 1 : 22 : n.d. | 5 : 1 | 96 | 95 |
| 10 | 1 : 26 : n.d. | 26 : 1 | 92 | 96 |
| 11 | 1 : 16 : n.d. | 29 : 1 | 99 | 95 |
| 12 | 1 : 5 : n.d. | 16 : 1 | 97 | 98 |
| 13 | 1 : 9 : n.d. | 10 : 1 | 89 | 91 |
| 14 | 1 : 30 : n.d. | 8 : 1 | 91 | 95 |
| 15 | 1 : 25 : n.d. | 20 : 1 | 99 |
99 |
Table 1: Evaluation of the dirhodium TPCP catalysts for the C–H functionalization of pentane.
其实最有意义的结果不是entry 15,而应该是entry 2!,不过我坚信Davies也不傻,肯定后续又有一篇一级C-H的site-selective的文章在弄了。(其实懂行的人应该大概知道怎么能提高末端一级碳的插入选择性了,小编在这边也不便把自己的idea说出来)
选择性探讨(小编个人想法,图画的有点难看,请担待)
这个,出了结果就得深究为什么有这种结果出现,这也是干催化剂设计必备的素质,文章中作者给出了催化剂15的单晶图,那么小编就根据所学知识考虑了一番,得出以下结论。下图(Figure 4)左侧是催化剂的单晶图,单晶图可以看出这个催化剂的配体配置是down-up-down-up,这是一个D2对称的催化剂(具体参照第一回基础讲解)。从这个单晶图小编就开始给大家讲解下为啥会出这么好的stereoselectivity吧,请看下图右侧示意图。中间Rh上面的是叠氮与Rh催化剂形成的卡宾,这个卡宾中间体左右两侧都被两个朝上的配体挡住,而背后被卡宾的三氯乙基挡住,而只有前面空着,所以这就决定了卡宾的enantioface,也就是说烷烃只能从前面进攻(粉红色箭头),在这里就决定了enantioselectivity。而对于diastereoselectivity来说,由于反应的是C2的亚甲基位点,对于亚甲基的碳来说,左边是一个含有三个碳的基团,右侧是含有一个甲基的基团,所以当然是小的更容易钻进去了(右下角上面那个反应式),在这个时候就决定了其diastereoselectivity,结合这两个原因,最终该催化剂给出了很好的立体选择性。这个。。。不明白的可以qq群私M我~~对着图小编也只能解释到这里了。
Figure 4: Possible explanation of observed stereoselectivity for today’s topic
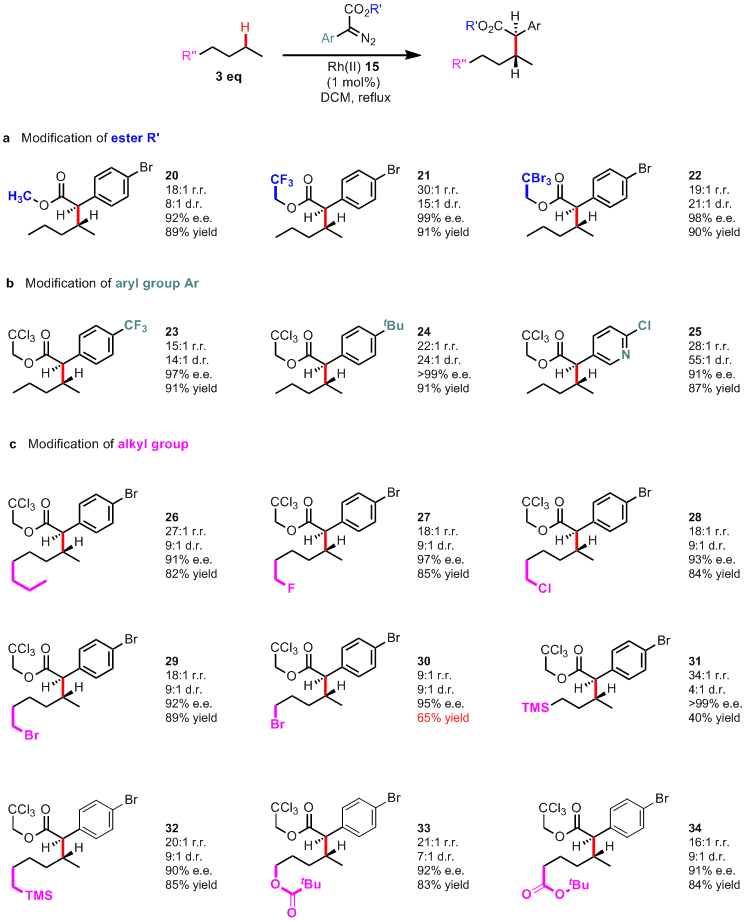
最后一步-扩底物
最后,毋庸置疑作者肯定要扩底物咯,也没太大的稀奇,都很好说明,首先下图(Table 2)的a中,讨论了下重氮底物得酯基部分的影响,这里还是电子效应,产物21中改用三氟乙基的话,明显这二级C-H的插入比例就上来了,达到了30:1。在b中,没啥好说的,反正就是立体选择性很好呗。在c中,这里有两个地方可以扯扯,第一个就是产物30,在底物戊烷的末端加了个溴后,产率降低了,这应该是溴具有一定的inductive效果,使得反应位点的C-H的电子密度减弱导致。而在那接TMS的话,请看产物31,从电子效应来说TMS是给电子的,应该产率提高啊,不过别忘了位阻的问题,刚刚上面小编就说到,要接近卡宾反应位点,含有三个碳的烷烃基团都够呛,别说TMS这么大了,所以这个底物的产率很低也就很正常了。
Table 2: C–H functionalization of alkanes and substituted n-alkanes.
小编结语
这篇文章被称为site-selective的C-H插入反应,就小编对于site-selective这个词的理解来说,有点言过其实。文章中使用的底物本身的反应活性就是C2那个位置最高,而作者使用的催化剂仅仅是放大了这个反应活性的差异,因为大家可以看到本身Rh2(DOSP)4这个常用的催化剂的所谓的site-selective就比最佳催化剂15要好。而小编心中定义的site-selective应该是逆反应性的,比如说一级C-H的选择性活化。当然作为大牛的Davies肯定比我们这种小博士牛逼多了,或许已经得到了一定的结果(从Table 1的entry 2中可以得到启发)。这篇文章的point只能说是在stereoselective上,最终能发在nature上,只能说大牛的名字还是很有用啊。如果换做一般人,能上个Nat. Chem估计就到顶了。不过近年来随着铑催化界另一大牛橋本 俊一教授(Shun-ichi Hashimoto)的退休,能够引导这个领域继续发展的也只有Huw M. L. Davies了。小编个人的氢键控制的新型羧酸铑催化剂的文章最近也到了收尾阶段了,希望能为这个领域也带来点新的什么。
今年由于一直很繁忙,所以深度分析论文的记事减少了很多,在这里敬请大家谅解。chem-station中文版是小编博一那会儿被JOJO拉入伙,一起开始的,这三年不到的时间得到各位老师,同学的支持与帮助,在这里深表感谢。同时chem-station也会一直做下去,为中国的化学发展贡献一丁点儿力。
参考文献
- Teyssie, P. et al J. Chem. Soc., Chem. Commun. 1981, 688.
- Chi-Ming Che, et al, Angew. Chem. Int. Ed. 2008, 47, 9747.
本文版权属于 Chem-Station化学空间, 欢迎点击按钮分享,未经许可,谢绝转载!























No comments yet.